《药品生产质量管理规范(GMP)》2010版附录《计算机化系统》作为药品生产质量管理体系的重要组成部分,对计算机系统在药品生产、质量控制等环节的应用提出了明确要求。本文从整体框架和核心条款两方面进行解读,帮助相关从业人员深入理解并有效实施。
一、整体框架概述
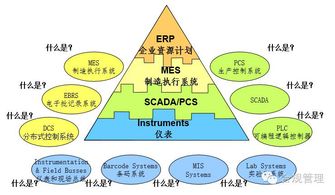
2010版GMP附录《计算机化系统》共分为六章,包括总则、人员与职责、系统验证、数据完整性、系统安全与备份、审计追踪等内容。其核心目标是确保计算机化系统在药品生命周期中的可靠性、数据完整性与合规性,降低药品质量风险。
二、核心条款精华解读
1. 系统验证要求
条款明确计算机化系统必须经过完整的验证流程,包括设计确认(DQ)、安装确认(IQ)、运行确认(OQ)和性能确认(PQ)。验证文件应详细记录验证过程与结果,确保系统符合预定用途。
2. 数据完整性原则
系统应确保数据准确、完整、可靠且不可篡改。采用电子签名、审计追踪等技术手段,防止数据丢失或修改。数据存储需满足可追溯性要求,保留时间符合法规规定。
3. 系统安全与访问控制
必须建立严格的权限管理机制,区分不同用户角色(如管理员、操作员、审计员),确保敏感操作仅限授权人员执行。系统应具备防病毒、防入侵等安全措施,并定期进行安全评估。
4. 系统服务与供应商管理
条款强调计算机系统服务供应商需具备相应资质,并提供持续的技术支持。企业应对供应商进行审计,确保其服务符合GMP要求。系统变更、升级或维护均需记录并评估对产品质量的潜在影响。
5. 备份与灾难恢复
系统需定期备份关键数据,并制定灾难恢复计划,确保在系统故障时能快速恢复运行。备份数据应存储于安全位置,并进行定期恢复测试。
三、实施建议
企业应结合自身实际情况,制定详细的计算机化系统管理规程,加强人员培训,确保系统从选型、验证到日常运维均符合GMP要求。定期开展内部审计,持续优化系统性能与合规性。
2010版GMP附录《计算机化系统》的实施不仅是法规要求,更是保障药品质量与患者安全的重要举措。通过深入理解条款内涵并有效落实,企业能够提升质量管理水平,为药品安全保驾护航。